活化蛋白C(APC)是一種抗凝血絲(si) 氨酸蛋白酶,來源於(yu) 兩(liang) 條鏈,依賴於(yu) 維生素K的酶原,蛋白C(3-7)。α-凝血酶和血栓調節蛋白之間的複合物催化蛋白C重鏈中Arg-12(牛中的Arg-14)的單裂,從(cong) 而生成活化的C蛋白。幾種非生理相關(guan) 的蛋白酶,例如RVV-X激活劑,胰蛋白酶和PROTAC也能夠激活C蛋白。
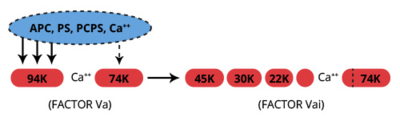
APC用作抗凝血劑,可催化輔因子Va和VIIIa因子的蛋白水解失活,從(cong) 而導致凝血酶原酶和Xase因子複合物的抑製。因子Va和VIIIa的失活都是Ca2 +和磷脂依賴性的。維生素K依賴的輔因子蛋白S通過與(yu) APC形成1:1的複合物(Kd = 6x10-9M)適度提高了失活率(8)。
有幾個(ge) 因素減弱了APC的抗凝活性。Xa因子通過競爭(zheng) 因子Va上相似的結合位點來保護因子Va免受APC的蛋白水解作用。凝血酶也已被提議通過蛋白S的蛋白水解失活作為(wei) APC的調節劑。此外,APC還受循環肝素依賴性蛋白的調節C抑製劑(PAI-3),肝素非依賴性循環蛋白C抑製劑,血小板衍生的蛋白C抑製劑和PAI-1。據報道,在APC和兩(liang) 種PAI類型之間形成的複合物可說明在輸注APC或體(ti) 內(nei) 產(chan) 生APC時觀察到的纖維蛋白溶解增加。
除了我們(men) 的標準APC製劑以外,還可以使用含有Dansyl-EGR-氯甲基甲酮的活性位點封閉形式。
活化的蛋白C是由純化的蛋白C通過凝血酶激活,然後進行離子交換色譜法製得的(4)。APC以50%(體(ti) 積/體(ti) 積)甘油/水的形式提供,應儲(chu) 存在-20oC下。通過SDS-PAGE分析確定純度,並使用生色底物測定法測量活性。還按照APC耐藥性分析的要求測試了所有生產(chan) 批次的APC延長正常人血漿aPTT的能力(10,11)。每個(ge) 批次的測試結果均以aPTT(+/- APC)比(10nM APC)的形式提供。